固体電解質の電子状態
Ag+イオン伝導体 Li+イオン伝導性固体電解質
固体電解質とは
電気伝導性は、電荷を運ぶ荷電粒子が移動をすることで生じる物性で、様々な物質で観測されます。電子が電荷を運ぶ場合は電子伝導性、イオンが運ぶ場合はイオン伝導性と呼ばれますが、金属などの固体の場合は電子伝導性を、電解質が溶けた溶液はイオン伝導性を示すことがよく知られています。しかし、ヨウ化銀のα型の結晶や、β-アルミナと呼ばれる物質では、電解質溶液と同じようにAg+イオンやNa+イオンが移動することで、電気伝導性を示します。このような性質を示す物質を、固体電解質と呼びます。固体電解質の存在は古くから知られていましたが、高いイオン伝導性を示す硫化物系固体電解質が発見されて以来、電池の電解質溶液を固体電解質に置き換えた全固体電池の実現の可能性が高くなり、注目を集めるようになりました。電子に比べて非常に大きく重いイオンが、非常に束縛の強い固体の中で移動するという現象には、局所的な化学結合、長距離にわたる伝導パスの形成など、様々な要因が影響を与えることになります。私たちの研究室では、特に伝導イオン周辺の局所的な電子状態に注目し、高いイオン伝導性を示す固体電解質の物性の解析を行っています。
Ag+イオン伝導体
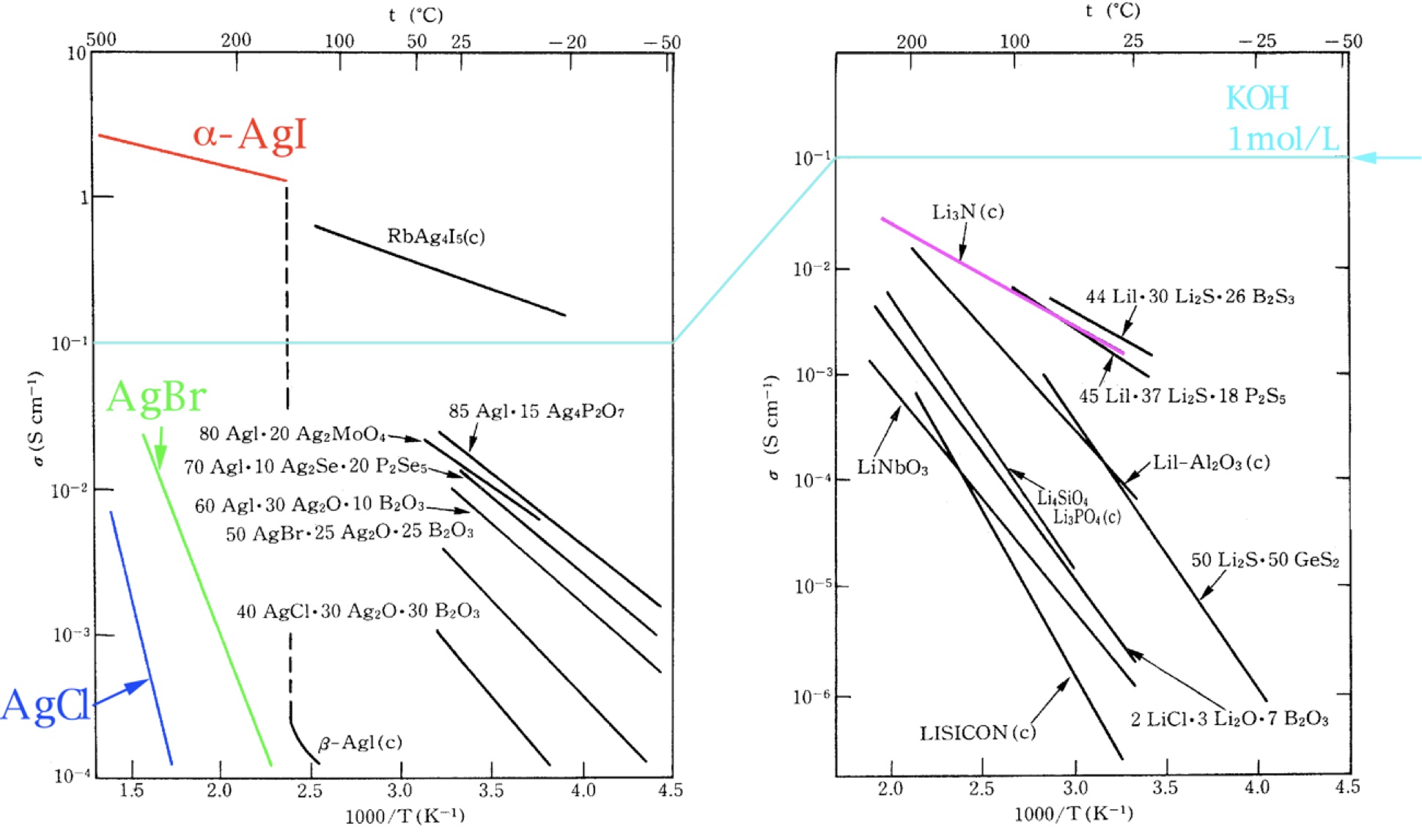
α-AgIを初めとするAg+イオン伝導性を示す固体電解質
α-AgI中のAg+イオンの移動に伴う電子状態の変化
α-AgIは、古くから知られる固体電解質のひとつです。特にAg+イオンのイオン伝導度が101Scm-1と極めて高いことが特徴ですが、α相は147℃以上で安定に存在するため、室温で利用することは困難でした。しかしながら、超急冷法を用いてAgIを多量に含むガラスを作製することで、ガラスマとリックス中にα-AgIの微結晶を閉じ込めることが可能となりました。
一方で、Agイオンは原子量の大きいイオンであり、それが非常に動きやすい理由については、様々な考察がなされてきました。我々は、第一原理分子軌道法のひとつであるDV−Xα法を用いて、α-AgI中の移動イオンの電子状態を算出し、その理由について検討を行いました。
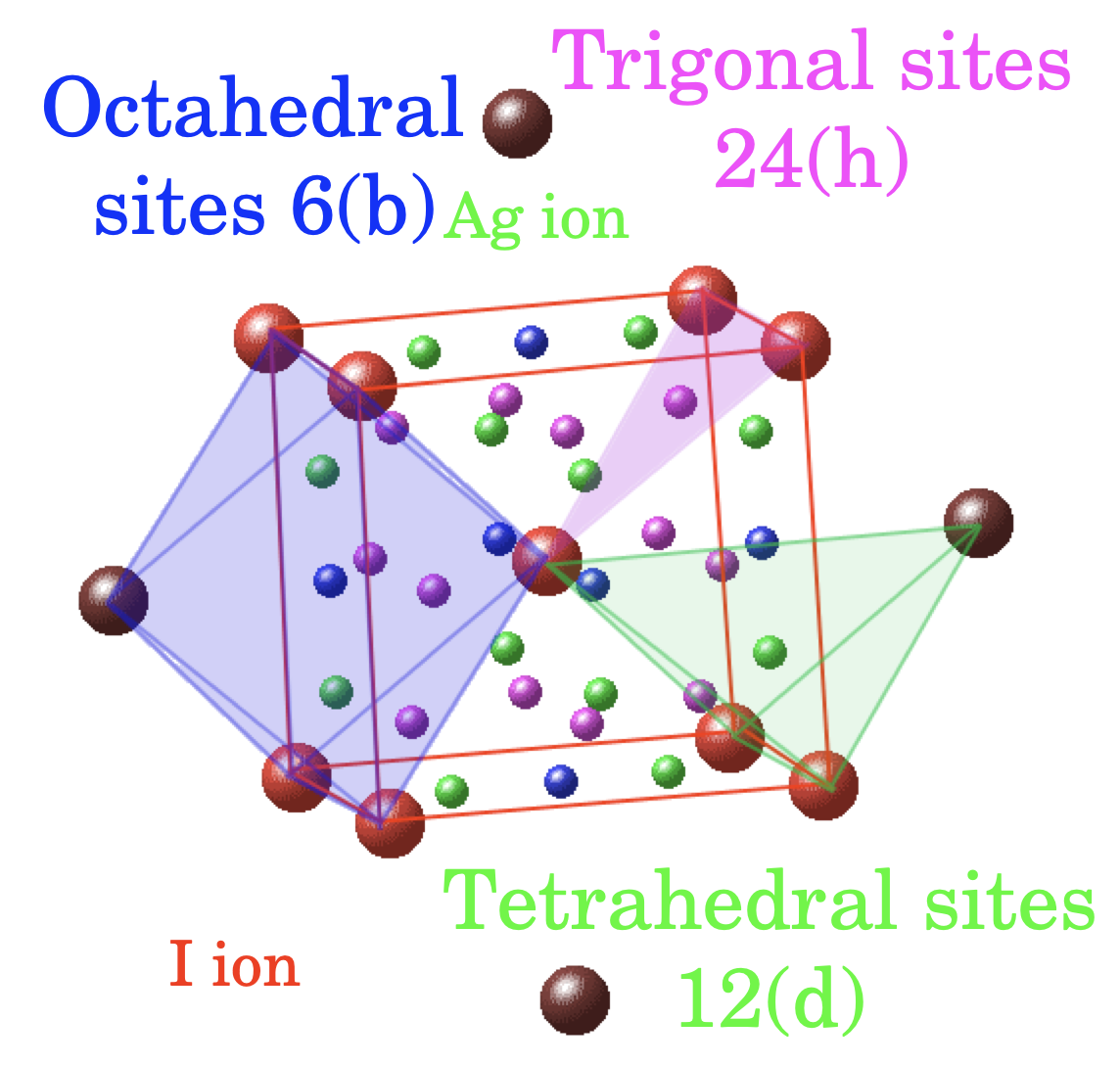
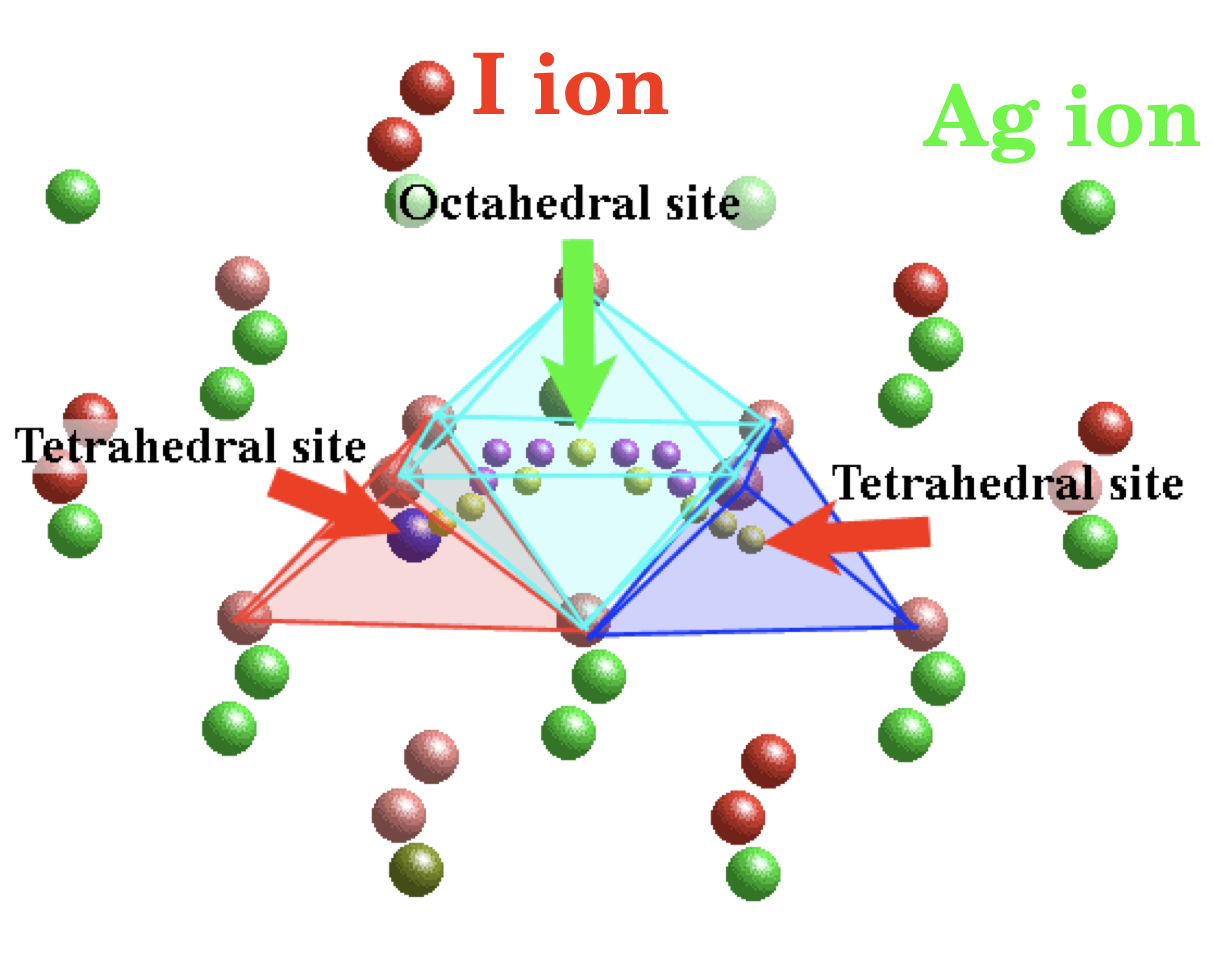
α-AgIの結晶中では、Ag+イオンは絶えず動いていますが、Agイオンが存在すると考えられる42のサイトの内、Iイオンが4配位するサイトに存在する確率が最も高くなることが、X線回折などの実験から明らかになっています。通常、固体中でイオンが移動する際には、特定の伝導パスに沿って動くことになります。その際、安定なサイトとサイトの中間点付近に、エネルギー的に不安定になるサドルポイントと呼ばれる場所があります。局所的に見た場合、このサドルポイントにおいて、移動するイオンを安定化してエネルギーを下げるような相互作用が生じることが、イオン伝導の活性化エネルギーを下げることにつながると考えられます。そこで、α-AgI結晶の構造から、Agイオンの4配位サイト間を結ぶ伝導パスを含む構造を切りだしたクラスターモデルを作製し、その電子状態を検討しました。通常、分子軌道計算では、原子の移動を明示的に取り入れることは困難ですので、Agイオンの位置を伝導パスに沿って少しずつ変えたモデルを複数個用意し、それぞれの電子状態を比較することで、イオンの移動に伴う電子状態の変化を求めました。
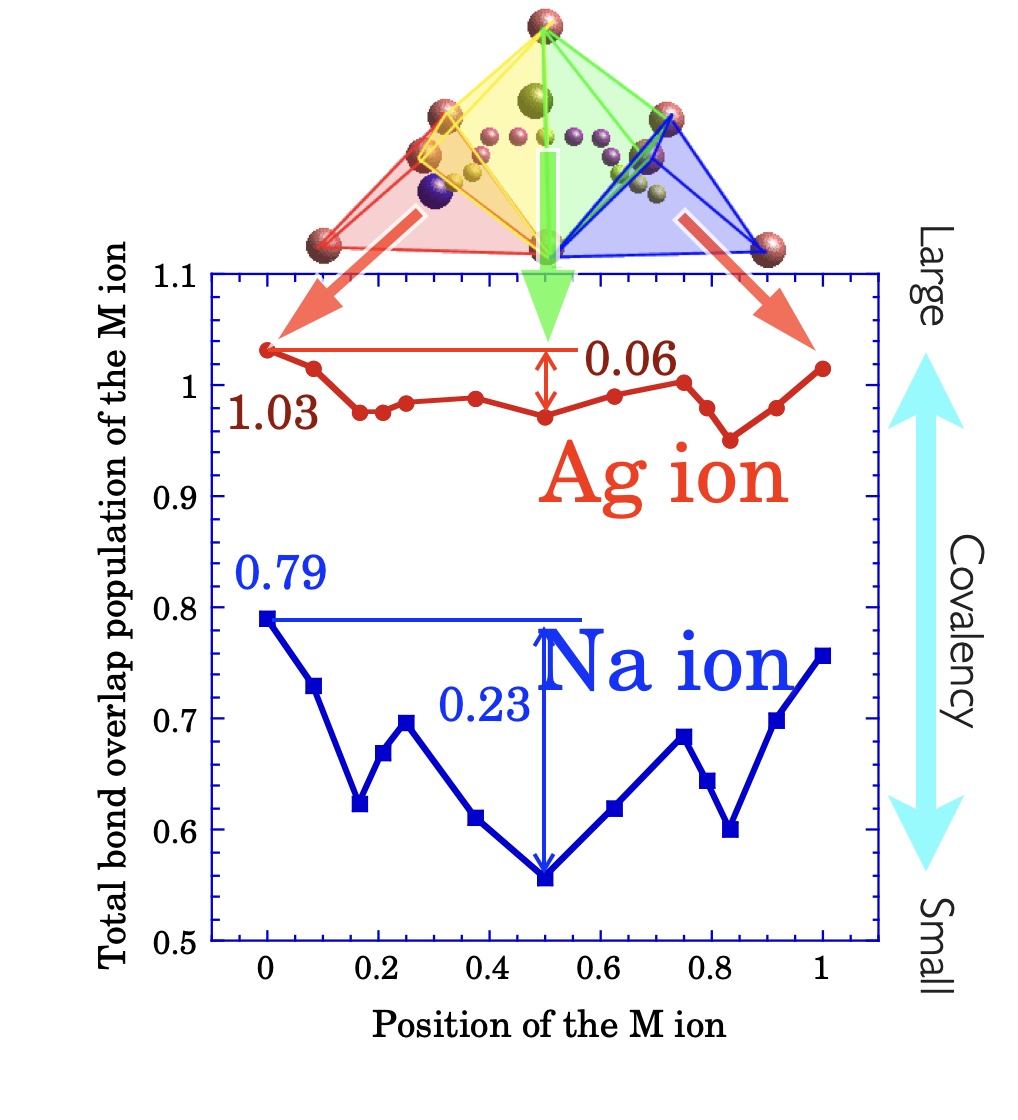
α-AgI結晶中でのAgイオンの移動の際の、電子状態、特に化学結合状態を検討したところ、イオンの実効電荷の変化よりも、Agイオンと周辺のイオンとの間の共有結合性の相互作用に特徴があることがわかりました。右図は、Agイオンが移動する際の、周辺の全てのイオンとの間の共有結合性の相互作用の総和と、移動する位置との関係を示したものです。図には、比較のためにAgイオンと同じ1価でほぼ同じイオン半径を持つNaイオンを用いた結果も併せて示しています。図中、横軸の0と1の位置が安定な4配位サイト、0.5の位置が最も不安定になると考えられるサドルポイントにあたります。また、縦軸は共有結合性の指標であるBond Overlap Population (BOP)を示しています。Naイオンの場合、安定なサイトでは周辺のイオンと総計で0.8程度の共有結合性の相互作用を持ちますが、サドルポイントの0.5では、BOPが0.56と大きく減少します。このことは、Naイオンが移動する際には、サドルポイントで共有結合性の結合エネルギーが大きく減少すること、つまり活性化エネルギーの大きな増加に対応することになります。一方で、Agイオンの場合には、安定サイトにおけるBOPの総計が1.0程度とNaイオンより大きくなっており、Naイオンに比べて、より周辺イオンとの間の共有結合性の相互作用が大きいことがわかります。しかしながら、サドルポイントにおけるBOPが0.97と安定サイトとほとんど変化がないことがわかりました。これは、サドルポイントにおいてもAgイオンの周辺イオンとの間の共有結合性の結合エネルギーはほとんど変化しないことになり、活性化エネルギーが非常に小さくなることに対応しています。
AgイオンのBOPがサドルポイントにおいてほとんど変化しない理由を調べたところ、移動するAgイオンと周辺に存在するAgイオンの間の共有結合性が大きな役割を果たしていることがわかりました。右のムービーは、α-AgI中でAgイオンが移動する際の共有結合性の相互作用を可視化したもので、図中、緑の球がAgイオン、紫の球がIイオンを、また水色の部分が電子密度が増加した部分を示しています。つまり2原子間で水色の領域が生成している部分が、共有結合性の相互作用が生じたことを示すことになります。図のちょうど中央がサドルポイントになっていますが、Agイオンがこの位置に来た際に、すぐ上にある別のAgイオンとの間に共有結合性の相互作用が生じることがわかります。このAg-Ag間の共有結合の形成により、サドルポイントにおいてAgイオンが安定し、これがイオン伝導の活性化エネルギーが小さくなる要因であることがわかりました。
Li+イオン伝導性固体電解質の電子状態
高いイオン伝導性を示す硫化物系Li+イオン固体電解質の電子状態
Li+イオン伝導性超イオン伝導ガラスの電子状態
Li2Sを多量に含む硫化物系ガラスは、高いLiイオン伝導性を示すことが知られており、超イオン伝導ガラスと呼ばれる固体電解質です。結晶とは異なりガラスの場合は長距離構造に規則性がないため、イオン伝導の際に特定の伝導パスを通るのではなく、ランダムネットワークに存在するランダムなパスを通って伝導すると考えられます。しかしながら、局所構造は結晶とガラスで大きな違いが見られないことから、イオン伝導性に対して局所的な化学結合状態が主な要因であると考えられます。そこで、右図に示すようなモデルを用いて、Liイオンの局所的な電子状態について検討を行いました。図中、MはLiイオンを、Xは骨格を形成する各種カチオンを、Sは硫黄イオンを示しています。ガラスの正確な構造を調べることは困難ですが、局所的平均構造は振動スペクトルや中性子線あるいはX線などの回折法によって得ることができます。
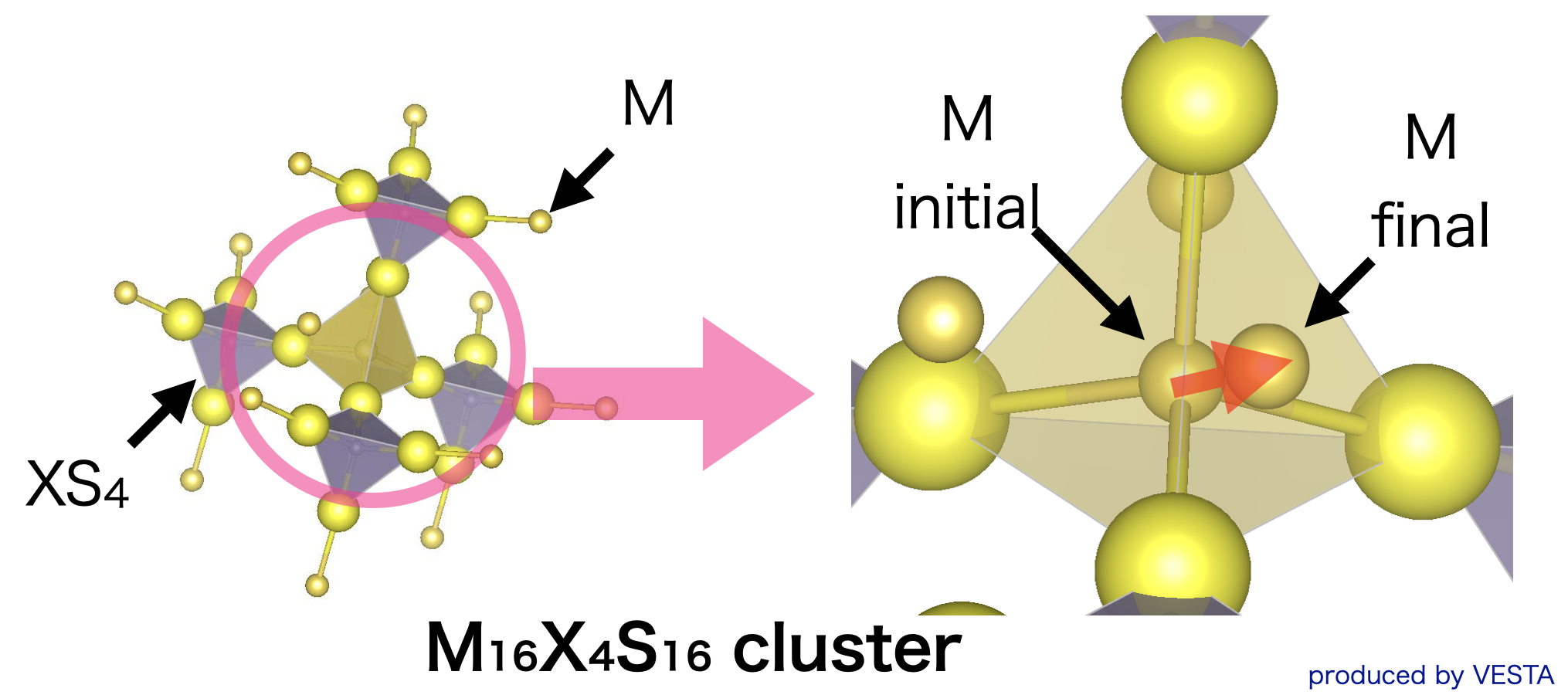
Liイオンの移動に伴う共有結合性の変化
これまでに固体電解質中のイオンの移動には、移動するイオンと周辺のイオンとの間の共有結合性が重要な役割を果たしていることがあきらかになっています。そこで上記モデルにおいて、安定サイトとサドルポイント(面上)とのLiイオンの総BOPの差分(DBOP)を求めました。下図は、60Li2S・40(xAlS1.5・(100-x)SiS2)で表される組成の超イオン伝導性ガラスについて、上記モデルを用いて計算を行い得られたDBOPと、イオン伝導度およびイオン伝導の活性化エネルギーを比較したものです。
左図は、イオン伝導度とDBOPの組成依存性を併せて示していますが、この系の場合、Al2S3含量が増すとイオン伝導度が低下する傾向を示します。一方で、DBOPはAl2S3添加量の相加に伴い、増加する傾向を示しました。また右図は、イオン伝導の活性化エネルギーとの比較ですが、活性化エネルギーはAl2S3含量が相加すると増加し、DBOPと類似した傾向を示すことがわかりました。DBOPは、イオン伝導度との間の相関係数が-0.91、活性化エネルギーとの間が0.90と高い相関を示しており、移動するイオンの共有結合性の変化が、イオン伝導性の要因のひとつであることが明らかになりました。
sis2)_dbop1.png)
sis2)_dbop2.png)
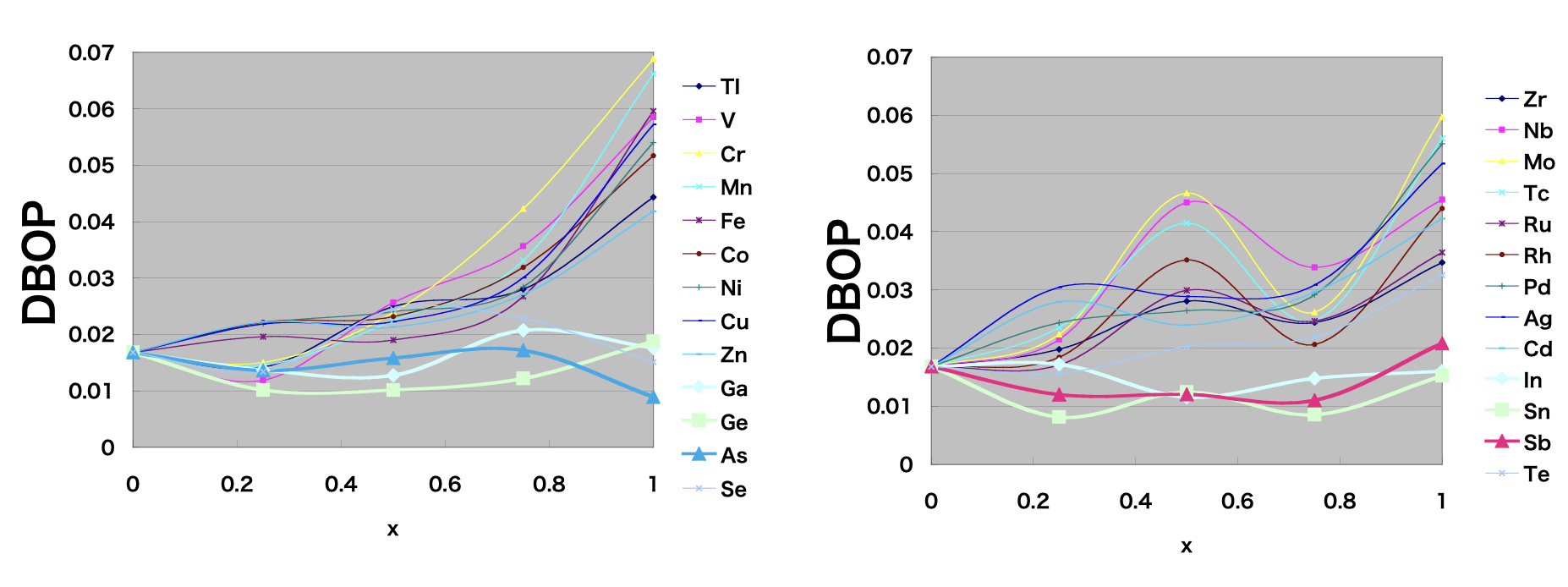
このモデルを用いてPと他の金属イオンを組み合わせた系についても同様の計算を行い、DBOPの組成依存性を求めました。左図は第4周期元素を、右図は第5周期元素をXS4の中心イオンとした場合の結果となります。また、横軸はP原子を他の原子に置き換えた割合で、組成に対応します。この図では、縦軸のDBOPが小さいほど、イオン伝導の活性化エネルギーが小さくなり、イオン伝導度が高くなると期待されることになります。これまで、Li2S-P2S5系に対して、GeS2等を添加した系ではイオン伝導度が高くなる傾向があることが報告されていますが、左図に示すようにP原子をGe原子に置き換えた場合には、DBOPが小さくなっており、実験事実と矛盾がないことがわかりました。
また、SnやSbなどでもDBOPは小さくなっていますが、これらの硫化物を含む固体電解質が高いイオン伝導度を示すことも実験的に示されています。このように、局所的なモデルを用いてイオン伝導のプロセスを調べることで、イオン伝導の活性化エネルギーなどを議論できることがわかりました。実際の固体電解質の場合には、結晶の材料が多く用いられることから、今後イオン伝導度の評価のために、長距離の伝導パスに関する情報を含めたモデルを構築することで、より詳細な議論が可能になるものと考えられます。